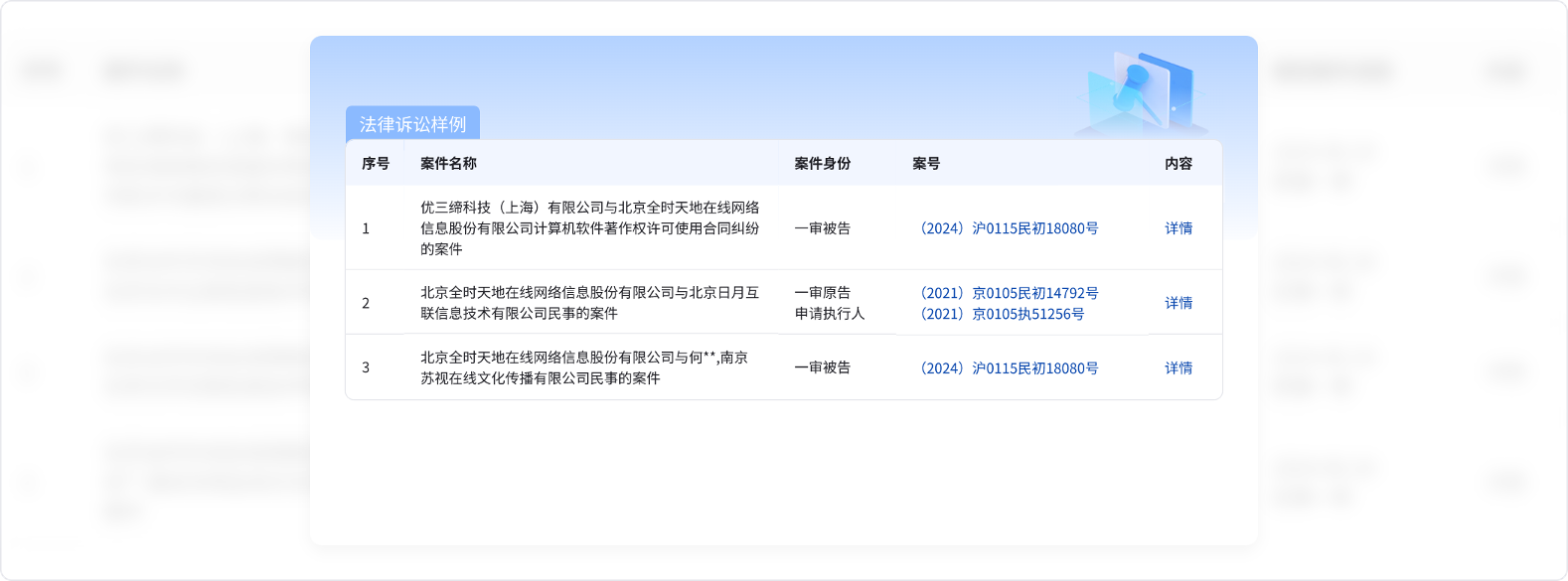
銅的化合物
(1)氫氧化銅和氧化銅
>1273K
4CuO==Cu2O+O2↑
≈353K
Cu(OH)2=加熱=CuO+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
Cu2+ + 2OH- =Cu(OH)2↓
(2)硫酸銅
(a)硫酸銅俗名膽礬或藍礬,其水溶液呈藍色
(b)硫酸銅的制備
加熱
Cu+2H2SO4(濃)====CuSO4+SO2↑+2H2O
加熱
2Cu+2H2SO4(稀)+O2====2CuSO4+2H2O
(c) 硫酸銅的加熱
無水硫酸銅加熱到923K時,分解成CuO
CuSO4==加熱==CuO+SO3↑
或者
2CuSO4==加熱==2CuO+2SO2↑+O2↑
(d)硫酸銅的用途
① 高中化學用無水硫酸銅檢驗水蒸氣的存在。
② 高中生物檢驗蛋白質時常在蛋白質中加入堿,再加入硫酸銅溶液,此時溶液會變為紫色,這個反應被稱為雙縮脲反應。
③ 高中生物檢驗還原性糖時用硫酸銅、氫氧化鈉制成斐林試劑,與還原性糖經沸水浴后作用生成磚紅色沉淀。
④ 應用領域無機工業用于制造其他飼鹽如氯化亞銅、氯化銅、焦磷酸銅、氧化亞銅、醋酸銅、碳酸銅等。染料和顏料工業用于制造含銅單偶氮染料如活性艷藍、活性紫等。有機工業用作合成香料和染料中間體的催化劑,甲基丙烯酸甲酯的阻聚劑。涂料工業用作生產船底防污漆的殺菌劑。電鍍工業用作全光亮酸性鍍銅主鹽和銅離子添加劑。印染工業用作媒染劑和精染布的助氧劑。農業上作為殺菌劑。
(3)硫化銅
Cu2++H2S=CuS+2H+
加熱
3CuS+2NO3-+8H+==3Cu2++2NO+3S+4H2O
2CuS+10CN-==2[Cu(CN-)4]3-+2S2-+(CN)2
(4)銅的配合物
(a)配陽離子:[Cu(NH3)4]2+
(b)配陰離子:[Cu(OH)4]2-
(c)配陽離子:[Cu(NH3)2]+
貼上您的名片
掃描二維碼進入虎易小程序投放名片,只需充值少量虎幣,即可張貼名片至
該產品“同類優質商家”欄目下,以相當低的成本獲得大量曝光。
投放說明
>
名片曝光使用說明
步驟1:創建名片
微信掃描名片二維碼,進入虎易名片小程序,使用微信授權登錄并創建您的名片。
步驟2:投放名片
創建名片成功后,將投放名片至該產品“同類優質商家”欄目下,即開啟名片曝光服務,服務費用為:1虎幣/天。(虎幣充值比率:1虎幣=1.00人民幣)
關于曝光服務
名片曝光只限于使用免費模板的企業產品詳細頁下,因此當企業使用收費模板時,曝光服務將自動失效,并停止扣除服務費。
<
返回首頁